
很近,催化臭氧方法在深度處理中的應用蓬勃發展,令人欣喜。自然,去除廢水中單位COD所需消耗的臭氧量(質量比),不僅是個重要的實踐問題,也有重大理論意義,暫且稱為“當量”。臭氧氧化有機物有兩種途徑:
一、臭氧的直接氧化
臭氧可以氧化很多有機物,盡管大部分有機物并不能徹底被氧化為CO2和H2O,它的理論當量可以通過化學反應式計算出。有個很著名的反應叫“Criegee臭氧化反應”(見百度百科),是臭氧氧化烯烴的反應:
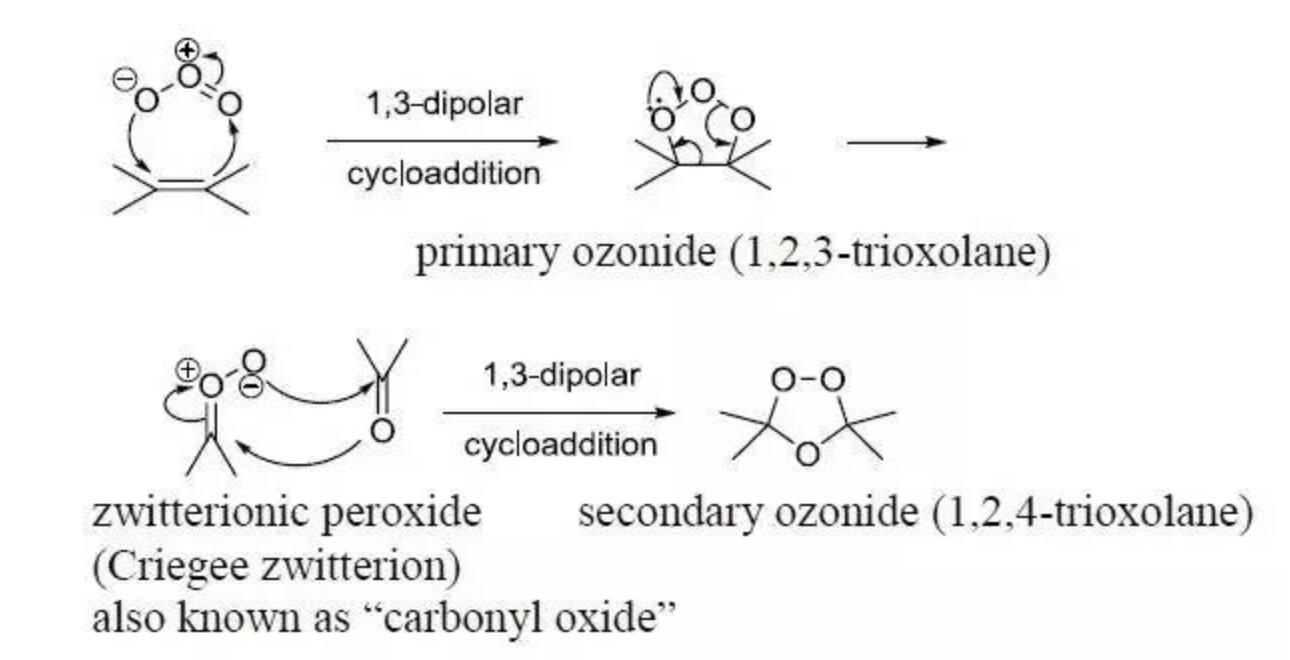
從式中可以看到,反應后臭氧中三個元素氧全部進入了有機物中,所以理論當量比(不考慮現實測定中反應物與產物不能測出COD值的情況)應為:
O3 : rCOD = 1.0
當然這是理論值,建立在純化學物質反應式基礎上的。
百度知道中,曾有人問:“在污水中,1kg臭氧能處理多少COD?”答:“臭氧起氧化作用的只有一個氧原子;所以用于處理COD的話,應該只有1/3起作用;能處理1/3kgCOD”。我在多個報告中都提及這個答案,并指出它是錯誤的。
二、形成羥基自由基的間接氧化
關于實際廢水深度處理中臭氧的理論消耗量的問題,2016年前后始終困擾著我。逐漸地,我形成這一調研思路:先弄清臭氧形成自由基的反應式。
哈爾濱工業大學馬軍教授2006年指導的博士論文有描述:
1:O3 + OH-→ HO2- + O2
2:O3 + HO2-→ • OH + O2•-+ O2
3:O3 + O2•-→ O3•-+ O2
O3 •- + H+→ HO3•
HO3• → •OH + O2
上述方程式在該論文中表示臭氧在蒸餾水中的分解,并指出:3分子的O3可生成 2分子·OH 。
而在該論文闡述異相催化機理時,引用了類似下圖:
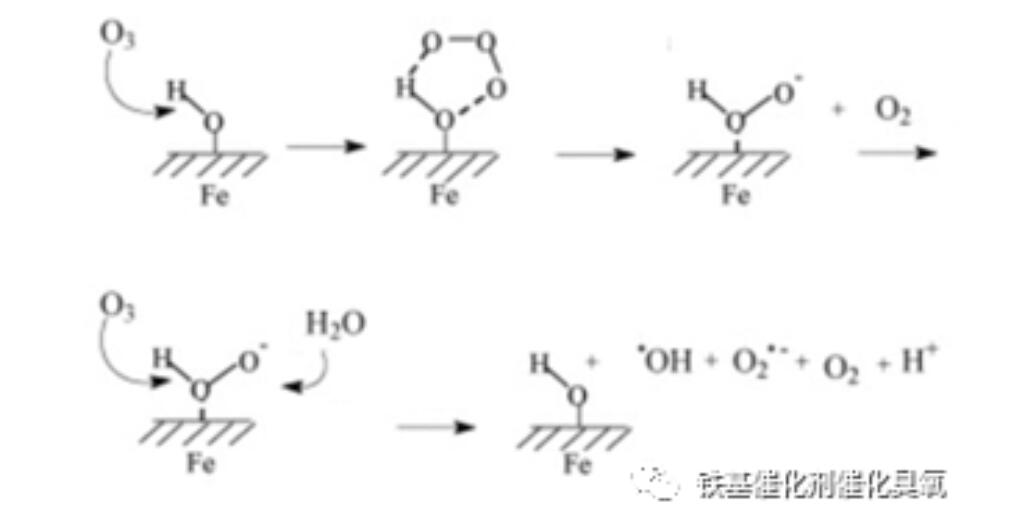
這張圖,是我根據該論文改繪的(見文獻:Tao Zhang, Jun Ma∗. Catalytic ozonation of trace nitrobenzene in waterwith synthetic goethite. Journal ofMolecular Catalysis A: Chemical 279 (2008), 82–89),原理未動,主要是為配合上述化學反應式,稍做改動。由此我認為:不論是臭氧在液相、還是在催化劑表面,形成自由基反應步驟是一樣的。
關于自由基主導的氧化反應,有較多的報道:
RH + •OH → R• + H2O (1)
R• + O2 → ROO• (2)
ROO• + RH → ROOH + R• (3)
R• + H2O → ROH + H • (4)
H• + O2 → HO2• (5)
HO2 • → H++ O2—• (6)
R• + O2—• → ROO— → … → CO2 + H2O (7)
如果認為反應至(6)結束,則得出結論:一個·OH誘導 2O2參與氧化。
結合自由基產生和自由基誘導氧化有機物兩步反應,可得出高級氧化時臭氧的理論當量比:
O3 : rCOD = 9 : 8
這個理論值是我獨立推導的,但推導過程極其粗糙,甚至不敢斷定是否有普遍意義,我在歷次會議上都這么強調;并告知,兩步反應分別是其他學者的成果。
推導這個理論值,我是否是第一人呢?不能確定,因我看的文獻有限。但在我查閱到的文獻范圍內,沒有見到其他人推導。盡管推導出這個值只要初中文化水平就夠了,但重要的是將兩類過程聯系起來。我認為:認真研究這一理論值,對完善臭氧化深度處理理論,有重要意義。
上述推導, 很遲于2017年我在多次報告中都有講述,在公眾號【技術探討】【持續研討】“16、關于催化劑單元化裝置”章節,記載了全部內容,且表明了“原創”。
為什么說上述推導過程是極其粗糙的呢?
以自由基主導的氧化反應七式為例:反應至(6)式,產物中仍有個O2—•,若我們認為它與水迅速發生歧化反應,生成O2、H2O2、OH−等穩定物質,上述討論就可成立。
但涉及到自由基的反應太多、太復雜,如:R• 與H2O反應,即(4)式;當然R• 也可以與O2反應,即(2)式;R• 與O2—•反應,即(7)式。還有反應速率常數問題,但自由基壽命都極短(•OH只有納秒級),如何計算反應速率常數,我還沒有搞懂。
今天討論這個議題,并非在我工作計劃中。源于6月3日上海世環會召開了“2019工業廢水提標改造的新技術、新設備高級研討會”,上午我做了一個“廢水深度處理方法淺析及綠色工藝 — 催化臭氧研討”的報告,之后我只聽了南京工業大學環境學院院長徐教授所做的報告,他也有講催化臭氧氧化工藝,報告內容之豐富、論證之嚴謹,給我留下深刻印象。
據同行說,下午某一大公司專門報告了他們的催化臭氧技術,并有大量的工程案例。這很好么,大家都在推進臭氧技術的應用,在這個意義我們都是“同一戰壕中的戰友”。但不幸的是:報告人還有講到臭氧的理論消耗量問題,把上述兩個過程的反應式都展示了,明確了9:8為1.125的關系。這也沒有問題,只要交待這是他人成果。問題在于:報告人引用了“臭氧直接氧化”作為比較,認為“臭氧直接氧化”當量是3:1,與“百度知道”的答案對號入座。
由前述分析可以知道,對于臭氧的直接氧化,必有反應式,即可由純物質參與反應式推導出臭氧當量。對于能夠與臭氧反應的有機物,理論值可達到1;但因為臭氧直接氧化能力弱、氧化有機物種類特異性強,很難找到對應實際廢水COD的當量通式。而對于臭氧的間接氧化,即形成羥基自由基的氧化,適應性廣,對于一大類屬于所謂“促進劑”的有機物,可由上述兩步反應描述氧化過程,由此可推導出9:8的關系。氧化有機物的兩類反應,性質有明顯的差異;弄不清這種區別,就沒有掌握催化臭氧氧化的實質。遺憾的是,該大公司報告人在這一點上犯了點小錯誤,說明他沒有搞懂“臭氧直接氧化”和“理論COD值“的本質,有可能是對別人報告的囫圇吞棗。
當然上述爭論,并不涉及職業道德問題。科學的發展,就是容錯和糾錯的過程。我同樣歡迎別人,從理論方面質疑我的成果。但有一點,我想提醒某大公司的報告人:
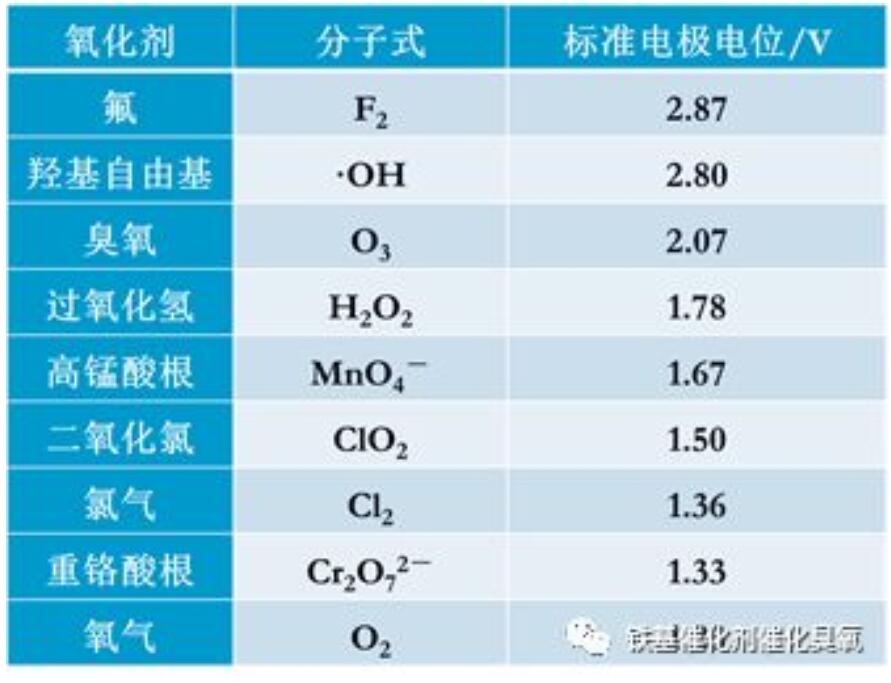
此圖,我歷次報告中都用,盡管圖中所有數據都是引用的,但表格是我制作的,我的書寫習慣都嵌入其中,比如說是陰離子,我喜歡用全角“—”作為上標。若直接拷貝,雖不是什么大問題,但明顯抄襲是說不過去的。代表大公司的報告,應慎之又慎。
本文作者馬魯銘,歡迎大家討論,歡迎大家批評指正!
標簽:臭氧氧化(12)有機物(3)













