
臭氧降解PCB有機廢液實驗方法與結論
1 材料和實驗方法
1.1 材料和試劑
氧化鈣 (CaO)、氫氧化鈉 (NaOH)、硫酸 (H2SO4)、異丙醇 (C3H8O)、正己烷 (C6H14)、乙二醇單丁醚 (C6H14O2)、吐溫-80、碘化鉀 (KI)、硫代硫酸鈉 (Na2S2O3)、叔丁醇 (C4H10O)和水楊酸 (C7H6O3)購于中國成都科隆化學試劑廠。二乙二醇單乙醚 (C6H14O3),2,3-二羥基苯甲酸 (C6H14O4)和 2,5-二羥基苯甲酸 (C6H14O4)購于梯希愛 (上海)化成工業發展有限公司。所有試劑均為分析級,無須進一步處理,所有溶液均是由超純水凈化機(ATSro)獲得的去離子水制備。
PCB廢液來源于某工廠制造 PCB過程,PCB廢液為黃色,略帶刺激性氣味,pH為 10.10, COD高達 20 246.4 mg·L−1,屬于堿性高濃度有機廢液,主要成分為異丙醇、正己烷、二乙二醇單乙醚、乙二醇單丁醚和吐溫-80等。
1.2 分析表征方法
通過UV光譜(Shimadzu,Japan)檢測水楊 學酸及其與 · OH 的反應產物,波長掃描范圍為260~400 nm。通過 LC-MS(LCMS-8060)對水楊酸羥基化產物進行定量分析。PCB廢液中的降解過程中的中間產物通過 GC/MS(Agilent 7890A)檢測。采用掃描電子顯微鏡 (SEM)檢測催化劑使用前后的形貌。通過X射線衍射分析儀 (Empryean PANalytical B.V.)檢測催化劑使用前后的組成,測定 X射線為 Cu靶Kα射線 (λ=0.154 18 nm,加速電壓為 40 kV,發射電流為 40 mA,掃描角度為 10°~85°。用重鉻酸鉀法測量廢液處理前后的COD。通過pH 計(SevenEasyS20,Mettler Toledo)測定廢液pH。
1.3 PCB廢液降解實驗
催化臭氧化過程在半連續反應器 (內徑可調,總高度 25 cm)中進行,該反應器盛有 250 mL PCB廢液和一定量的 CaO用作催化劑,在常溫常壓條件下進行反應。臭氧由臭氧發生器產生,并通過曝氣石將 O3分散到廢液中,并且通過磁力攪拌使廢液與 O3接觸更充分。在實驗過程中,氣體流速為4 L·min−1,臭氧濃度通過靛藍法檢測,殘余臭氧用20%KI溶液吸收。
在催化臭氧化過程中,以異丙醇 (IPA)、正己烷 (nHA)、二乙二醇單乙醚 (DGDE)、乙二醇單丁醚 (EB)和吐溫-80(Tween-80)為原料,模擬 PCB實際廢液。將 3.0 g CaO加入到含有 250 mL模擬廢液的反應器中,然后通入一定濃度的臭氧以降解廢液中的有機污染物。在此過程中,以一定的時間間隔從反應器中取出 10 mL的降解液樣品,加入 Na2S2O3鈉溶液淬滅樣品中殘余臭氧。將獲得的樣品通過 0.22 μm 微孔膜過濾,并將過濾的樣品用于 GC/MS檢測分析。叔丁醇 (TBA)用作 · OH淬滅劑,水楊酸 (SA)用作 · OH捕獲劑,添加到催化臭氧化過程中以研究催化臭氧氧化過程的主要活性自由基。使用過后的催化劑經過過濾、洗滌、50 ℃干燥后,用于催化劑的穩定性實驗。
2 結果與討論
2.1 催化臭氧氧化過程降解機理
2.1.1 叔丁醇淬滅自由基實驗
臭氧與有機物的反應主要有 2種途徑,即直接反應和間接反應。直接反應是指 O3直接氧化有機物,間接反應主要是通過 O3分解產生的活性自由基對有機物進行氧化。通過研究 · OH淬滅劑的影響進行對比實驗,研究 · OH對有機物的降解作用。TBA 是一種常見的 · OH淬滅劑,它與臭氧分子基本不反應,反應速率僅 3×10-3 L·(mol·s)−1,而其與 · OH的反應速率高達 6×108 L·(mol·s)−1。因此,可以通過加入 TBA 到臭氧或催化臭氧過程,間接檢測體系中是否有 · OH 的產生。圖 1為單獨臭氧氧化過程以及催化臭氧氧化過程加入TBA前后廢液的 COD 去除率對比圖。由此可知,CaO催化臭氧氧化過程和單獨臭氧氧化過程加入 TBA后,處理 180 min后,COD去除率分別降低 13.04%和 5.71%,表明 TBA的加入對 2個過程降解率均造成負面影響,從而間接證明單獨臭氧氧化過程與催化臭氧氧化過程都有 · OH產生。此外,從 TBA對 2個過程的影響程度上可以看出,CaO可以促進 O3產生更多的 · OH,表明 CaO催化臭氧氧化過程遵循羥基自由基機理。
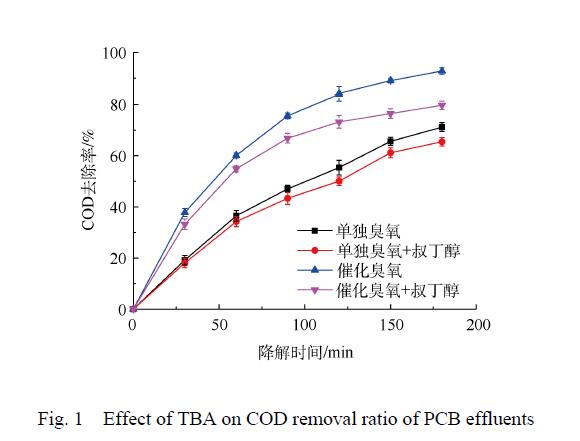
圖 1 TBA對PCB廢液降解率的影響
2.1.2 水楊酸羥基化實驗
水楊酸 (SA)羥基化實驗是另外一種間接檢測羥基自由基的方法。羥基自由基具有存在時間短、不穩定的特點,但 SA可以作為 · OH的捕捉劑,SA與 · OH反應后會生成較為穩定的 2,3-二羥基苯甲酸 (2,3-DHBA)和 2,3-二羥基苯甲酸 (2,5-DHBA)。本研究結合紫外-可見分光光度計跟蹤 SA與 · OH反應后產物,再結合液相色譜-質譜聯用儀對2,3-DHBA和2,5-DHBA 進行定量分析。
圖 2為 SA、2,3-DHBA和 2,5-BHBA的紫外-可見吸收光譜圖以及 CaO催化臭氧氧化處理后的紫外-可見吸收光譜。可以看出,SA在 302 nm處有 很大吸收峰,而 2,3-DHBA和 2,5-DHBA分別在315 nm和 330 nm處出現 很大吸收峰,SA經過催化臭氧氧化處理后 很大吸收峰波長向右移動,在2,3-DHBA和 2,5-DHBA的大吸收峰處有一定的吸收,證明在該過程中有 · OH產生。
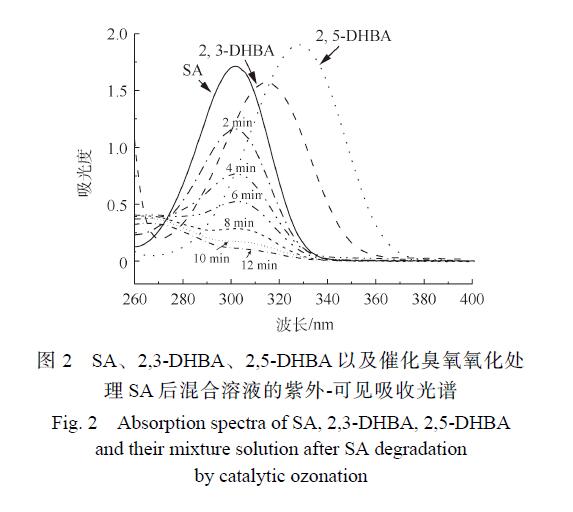
從圖2中可以觀察到2,3-DHBA和2,5-DHBA的存在,接下來使用LC-MS聯用儀對2,3-DHBA和 2,5-DHBA 的含量進行定量分析。圖 3(a)和圖 3(b)分別表示 2,3-DHBA 和 2,5-DHBA的液相色譜標準曲線,根據該標準曲線求得 CaO催化臭 氧 處 理 不 同 時 間 溶 液 中 2,3-DHBA和 2,5-DHBA的含量,結果如表 1所示。
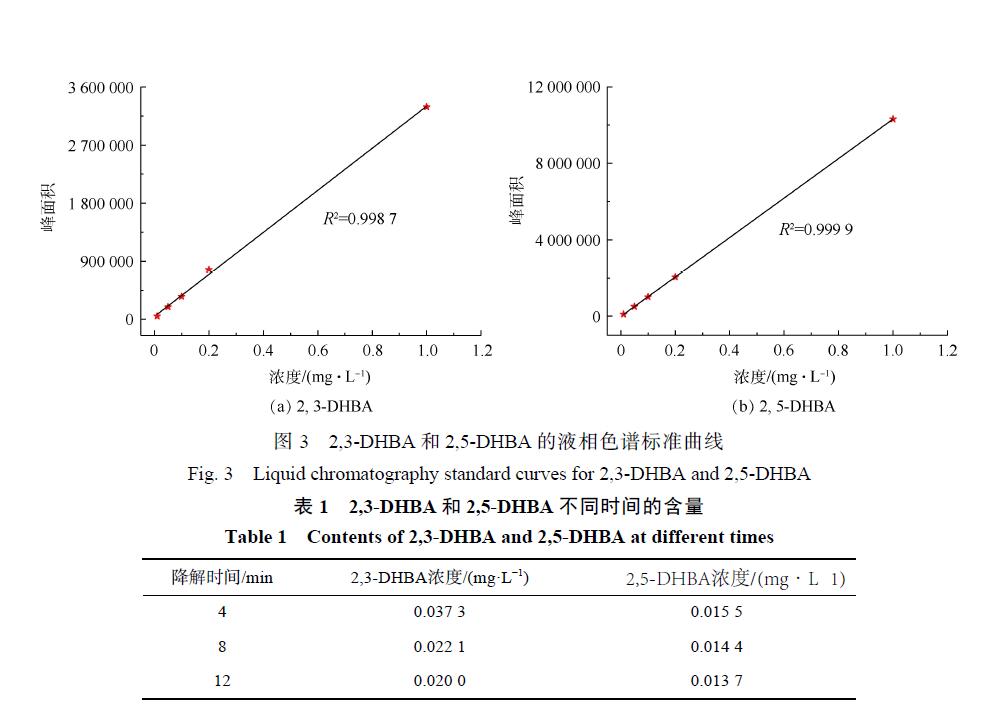
從表 1中可以看出,Ca環 O催化臭氧處理 4、8和 12 min后溶液中2,3-DHBA的含量分別為0.037 3、0.022 1和0.020 mg·L−1,2,5-DHBA 的含量分別為0.015 5、 0.014 4和 0.013 7 mg·L−1。可以看出,隨著時間的增加,2,3-DHBA和 2,5-DHBA的含量都不斷減少,表明催化臭氧過程中 SA與羥基自由基結合的同時,羥基化產物 2,3-DHBA和 2,5-DHBA 也被氧化降解。
2.2 有機物降解路徑
為了研究廢液的降解路徑,以廢液主要成分異丙醇和乙二醇單丁醚為例進行探討,對 2種物質進行降解并對降解產物用GC/MS進行檢測。
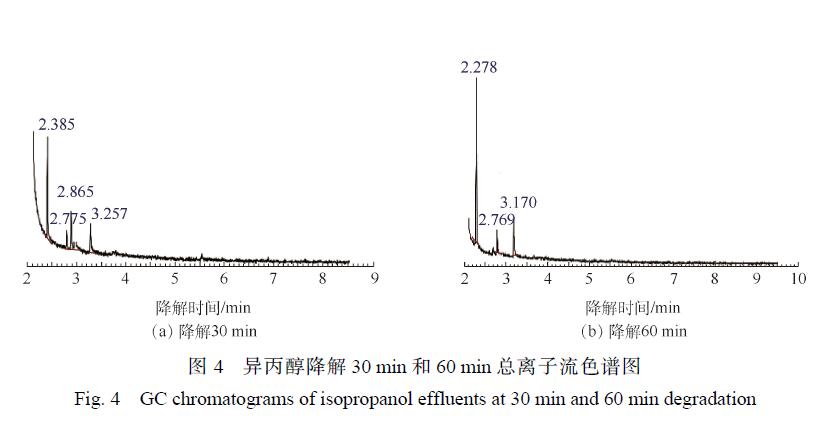
異丙醇降解 30 min和 60 min的 GC/MS結果如圖 4所示,對應的中間產物信息如表 2所示。異丙醇溶液經催化臭氧氧化降解 30~60 min后,檢測到的中間產物有羥基丙酮、1,2-羥基丙二醇以及乙酸,由此推測出異丙醇的可能降解路徑為:異丙醇與 · OH結合形成了 1,2-羥基丙二醇,1,2-羥基丙二醇再被氧化為羥基丙酮,然后再進一步被氧化為小分子酸乙酸,結果如圖5所示。
乙二醇單丁醚降解 30 min和 60 min后的總離子流色譜圖如圖 6所示,對應的中間產物信息如表 3所示。乙二醇單丁醚的降解中間產物主要有 1-丁醇、乙二醇、4-羥基-2-丁酮、丁內酯和乙酸。
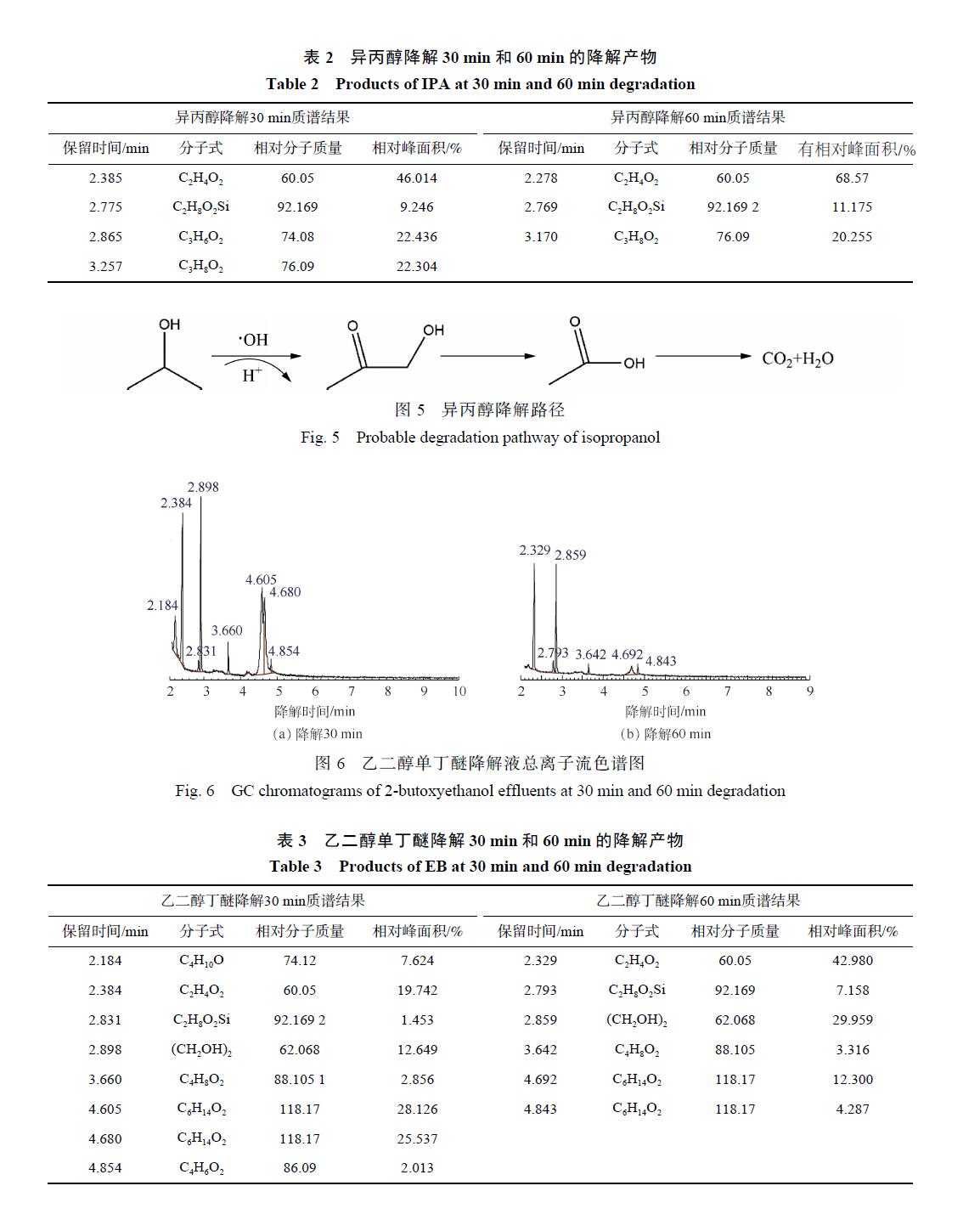
由此可以推測乙二醇單丁醚的可能降解路徑如圖 7所示,乙二醇單丁醚的降解一部分是被氧化斷鏈形成乙二醇,然后再接著被氧化為乙酸。
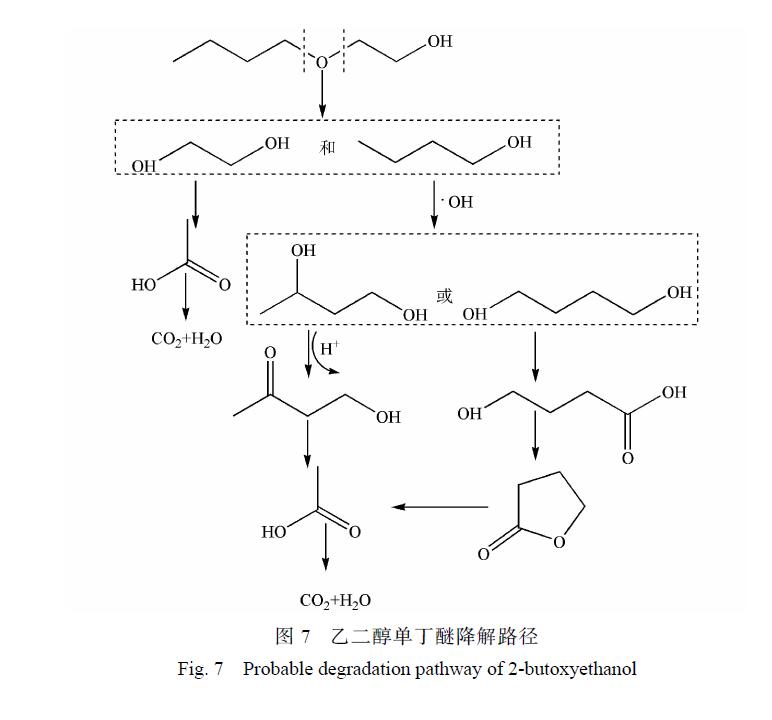
另外有一部分乙二醇單丁醚被氧化斷鏈形成 1-丁醇,1-丁醇與 · OH 結合,結合產物再被氧化形成酮或酸, 很后再被氧化形成小分子酸乙酸, 很后形成CO2和H2O。
2.3 催化劑的循環穩定性測試
在實際應用中,催化劑的穩定性十分重要。催化劑的多次循環使用可以節約催化劑成本,并且減少固廢。本實驗對催化劑進行了5次循環,每次使用后對催化劑進行過濾、洗滌、干燥后進行循環使用。如圖 8所示,催化劑在每一次使用時的催化效率分別是 92.78%、 90.67%、88.98%、86.94%和 84.04%。經過多次循環,催化劑活性下降,但每次循環均沒有顯著下降,表明該催化劑具有良好的循環性能。
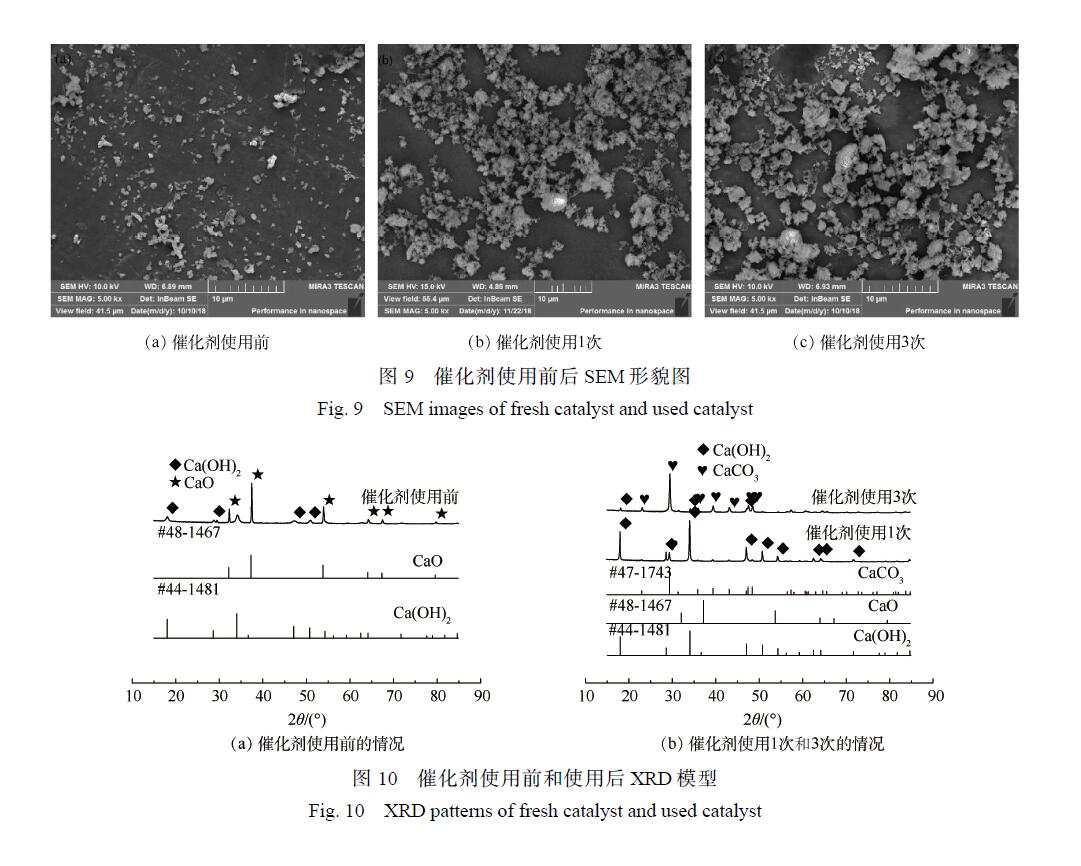
為了探討催化劑失活原因以及催化劑活化的方式,對使用前境后的催化劑進行了表征,研究催化劑使用前后的形貌、組成以及比表面積變化。圖 9(a)顯示的是催化劑使用前的形貌,圖 9(b)和圖 9(c)表示催化劑使用 1次和 3次后的形貌。可以看出,使用后的催化劑較使用前的催化劑不易分散,產生的團聚現象更為嚴重,從而導致催化劑的性能降低。
圖 10顯示的是催化劑使用前后的 XRD譜圖。圖 10(a)得到的 XRD譜圖與標準 JCPDS對照可知,2θ為 32.3°、37.4°、53.9°對應的是 CaO的特征吸收峰,2θ為 18°、28.7°、34.1°、47.1°和 50.9°對應的是 Ca(OH)2的特征峰,表明在使用前的催化劑中 Ca(OH)2的特征峰也有一定的吸收強度。使用前的催化劑中 CaO的特征峰十分清晰且強度較大,表明其主要成分是 CaO,但也含有少量的Ca(OH)2,說明催化劑在存放過程中或者樣品測試時受到空氣中水分的影響。
圖 10(b)為催化劑使用 1次和使用 3次后的 XRD圖。催化劑使用 1次后的 XRD譜圖在 2θ為18°、28.7°、34.1°、47.1°和 50.9°處存在較強的峰,這些峰與 Ca(OH)2的特征峰一致,表明其主要成分是 Ca(OH)2。而使用 3次的催化劑測出的 2θ為 23°、 29.4°、 39.4°、 43.2°和 47.1°對應的峰 是CaCO3的特征峰,說明催化劑的失活過程主要是:經過多次循環后的催化劑與水結合變成了Ca(OH)2,形成的 Ca(OH)2與礦化產物 CO2結合從而變為 CaCO3, 很終由于多次反應后 CaCO3含量不斷增加從而導致催化劑催化效率逐漸降低。
魯藍鍶,陳際達*,鄢婷,付登林,文亞男,鄧智博,張柔
重慶大學化學化工學院,重慶 401331
第一作者:魯藍鍶(1994—),女,碩士研究生。研究方向:催化臭氧氧化技術。
標簽:催化臭氧氧化(2)羥基自由基(2)氧化鈣(1)PCB 廢液(1)
相關文章:













