
臭氧在醋酸溶液中溶解及穩定性研究
【研究意義】臭氧是當前公認的強氧化劑,它具有高效的消毒滅菌能力[1],無二次污染,完全符合當今社會綠色環保無污染的發展潮流。因此,無論在國內還是國外,臭氧都被廣泛地應用在水處理、食品加工、醫療、運輸、儲存、農業等各個領域。但是,臭氧不能貯存,極不穩定[2],在常溫常壓下會緩慢分解成氧氣。研究臭氧的溶解特性,提高其溶解度具有非常重要的意義,能為更好地開發利用臭氧技術起到一定的鋪墊作用。【前人研究進展】關于臭氧穩定性的相關報道,國外有Tomiyasu等[3]、Taube等[4],國內有王華然等[5]研究了臭氧在水中的溶解特性及影響因素,發現水溫升高導致臭氧溶解度下降,發生器的氣體流量和水中色度會對臭氧在水中的溶解度產生影響。為了解決臭氧在水中的穩定性問題,許偉堅[6]選擇聚丙烯酰胺水溶膠來溶解臭氧,結果顯示,2.0 g/L聚丙烯酰胺臭氧水溶膠所得的初始臭氧濃度及半衰期數據 很理想,但溶膠在使用中不方便,其殘留物對環境帶來不良影響,而聚丙烯酰胺分子量大,易被氧化和降解,且單體丙烯酰胺對人體不利。有文獻認為OH-是臭氧分解的催化劑[7],添加醋酸[8]和檸檬酸可以降低溶液中OH-的濃度,從而抑制臭氧分解,對比試驗顯示醋酸的效果優于檸檬酸。方敏等[9]試驗證實,醋酸、檸檬酸可以大大提高臭氧的穩定性,但酸性過強會加速臭氧分解。 很近有研究發現,增強臭氧的堿性反而可以提高臭氧的穩定性,能有效地減少臭氧的分解[10]。而王華然等[5]的試驗卻表明,pH值對臭氧在水中的溶解無顯著影響。
【本研究切入點】 那么,酸度對臭氧在水中的溶解度及穩定性到底有何影響,酸的類型、濃度、溫度及水質對其是否會有影響,類似問題未見系統報道。【擬解決的關鍵問題】本研究針對醋酸濃度、溫度、水質等對臭氧在醋酸溶液中的溶解度以及穩定性進行試驗,探索醋酸濃度、溫度、配制醋酸溶液的水質、通入臭氧后的放置時間、處理時間等因素對臭氧在醋酸溶液中的濃度的影響,找出影響臭氧在醋酸溶液中溶解度的因素,并得出臭氧在醋酸溶液中溶解度 很高的 很佳條件,以期為臭氧技術在食品領域中深入開發利用奠定實踐基礎。
1 材料與方法
1.1 試驗材料
試劑:碘化鉀、冰醋酸、濃硫酸、硫代硫酸鈉、可溶性淀粉、重鉻酸鉀均為分析純,去離子水、超純水均為實驗室自制(無特別說明,試驗中用水均為去離子水)。
儀器:鼓風恒溫干燥箱;臭氧發生器,臭氧產生量5 g/h;傅里葉變換紅外光譜儀;電冰箱、電加熱爐、電子天平、攪拌水浴鍋。
1.2 試驗方法
操作方法:(1)配制0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1 mol/L共10個不同濃度的醋酸溶液,在25℃條件下,分別通入臭氧處理10 min,取樣測定每個樣品中的臭氧濃度。
(2)分別用自來水、去離子水和超純水配制醋酸濃度為0.6 mol/L的醋酸溶液,在25℃條件下,通入臭氧處理10 min,取樣測定每個樣品中的臭氧濃度。
(3)配制濃度為0.6 mol/L的醋酸溶液,在25℃條件下,通入臭氧處理10 min,分別放置30、60、90、120、150、180 min,在每個放置時間后取樣測定樣品中臭氧濃度。與此同時,讓臭氧通入去離子水作對照,在一樣的溫度、臭氧處理時間以及通氣之后放置相同時間段測定樣品中的臭氧濃度。
(4)配制4份濃度為0.6 mol/L的醋酸溶液,在25℃條件下,其中1份通入臭氧處理10 min之后放置3 h,1份通入臭氧20 min之后放置3 h,1份通入臭氧處理10 min未放置,1份不做處理,分別用紅外光譜分析醋酸的結構。
(5)配制濃度為0.6 mol/L的醋酸溶液,通入臭氧處理10 min,分別在5、20、30、40、50℃條件下取樣測定樣品中的臭氧濃度。
(6)配制濃度為0.6 mol/L的醋酸溶液,在溫度25℃的條件下,分別通入臭氧處理10、20、30、40、50、60、70 min,在每個時間段取樣測定樣品中的臭氧濃度。
臭氧濃度測定參照文獻[11],采用碘量法測定。如無特別說明,均在臭氧處理后立刻測定。
紅外分析采用KBr壓片,用紅外光譜分析醋酸的結構,掃描波長450~4 000 cm-1。
2 結果與分析
2.1 水中添加劑的選擇
由于O2的兩個氧原子共用1對電子,是直線型,因此屬于非極性分子。而臭氧結構中的中心氧原子供給的2個電子部分為兩邊的配位氧原子所有,即發生了離域,致使中心氧原子顯得正一些,兩邊氧原子顯得負一些。因此臭氧分子中的鍵矩不等于零,鍵有極性。而且其分子結構又不對稱,因此臭氧分子有偶極矩而顯極性。水屬于極性分子,根據相似相溶原理,臭氧應易溶于水,但事實上臭氧在水中溶解度并不高,且穩定性也不好。有文獻報道了一種大幅度提高臭氧在水中溶解度和穩定性的方法[12],就是在水中加入含氧有機化合物,這種方法簡單、方便、成本低。臭氧氧化性很強,電對O3/O2的標準電極電勢為1.24 V,一些具有還原性的有機化合物在水溶液中易于被臭氧氧化,基于這一點,再結合溶解性考慮,添加低分子有機酸應為優先選擇。從偶極矩上看,醋酸為5.60,甲酸為6.07,水為6.17[13-14],臭氧為0.53~0.55[15],醋酸與臭氧的差異比甲酸小,而且醋酸無毒無害廣泛用于食品領域。因此本研究選擇醋酸作為溶劑。
2.2 醋酸濃度對臭氧穩定性的影響
從圖1可以看出,在相同的試驗條件下,醋酸濃度0.1~0.6 mol/L范圍內,隨著醋酸濃度增大,溶液中臭氧濃度增大;當醋酸濃度大于0.6 mol/L時,隨著醋酸濃度增大,溶液中的臭氧濃度逐漸減小。方敏等[9]在研究臭氧在不同pH下的分解速率時發現,臭氧分解速率與pH呈不規則的“U”型,pH在3~4時,分解速率 很低,當pH大于4,隨著pH增大,分解速率不斷增加;當pH小于3,隨著pH減小,分解速率也不斷增加。代欣欣等[16]在研究水中臭氧溶解特性時發現OH-在臭氧分解反應中起著重要的催化作用。醋酸濃度增大時,溶液中的OH-減少,OH-的催化作用減弱,因此臭氧的分解減慢,穩定性提高,溶解度增大[17]。本試驗獲得高濃度臭氧的 很適醋酸濃度為0.6 mol/L。
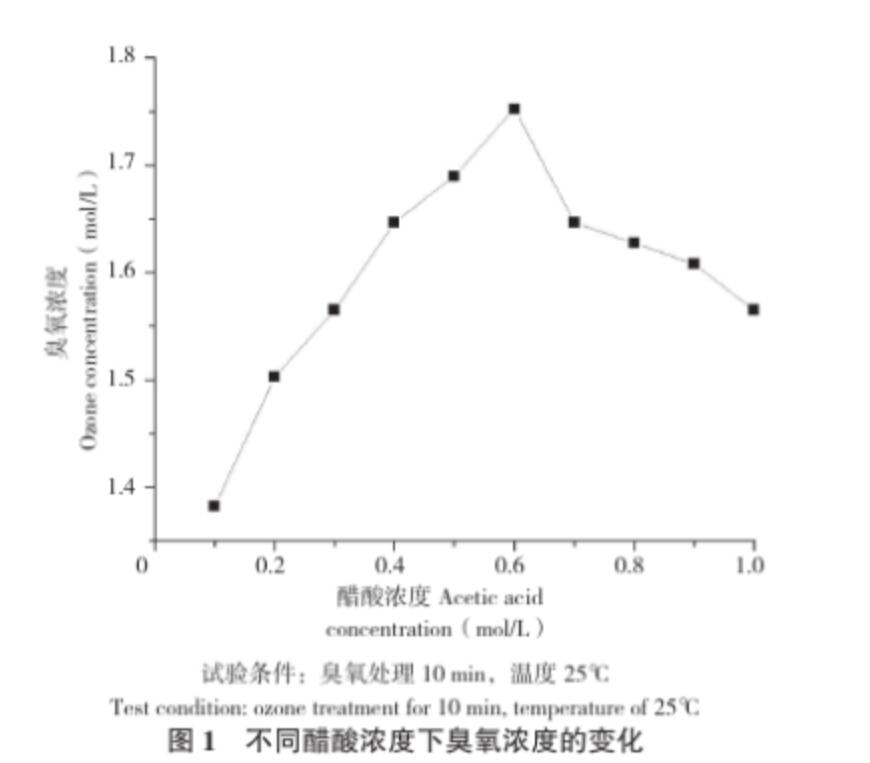
圖1 不同醋酸濃度下臭氧濃度的變化
試驗條件:臭氧處理10 min,溫度25℃
Test condition: ozone treatment for 10 min, temperature of 25℃
2.3 水質對臭氧穩定性的影響
從圖2可以看出,在相同的試驗條件下,不同水質配制的醋酸溶液中,臭氧的溶解度依次為超純水>去離子水>自來水。許榮年等[18]在研究臭氧對水質的影響時,發現良好的過濾裝置能使飲用水通過濾膜阻止細菌、霉菌、藻類的通過,還可去除雜質及部分有機物而變得澄清,使后期臭氧處理消耗更少的臭氧量,說明水越純凈,其含有的離子、雜質和礦物質等物質越少,臭氧在水中的分解速率則越慢,穩定性就越強,溶解度越大。方敏等[9]在研究臭氧水穩定性時,也證實了臭氧在水溶液中的穩定性與水質有關。孫廣明等[19]在研究臭氧特性及對水質的凈化作用時,通過實驗證明了臭氧在不同類型水中的分解速度有所不同,即水的純度高,臭氧分解慢,臭氧水穩定性就好;反之,水質差,臭氧分解快,臭氧水就不穩定。
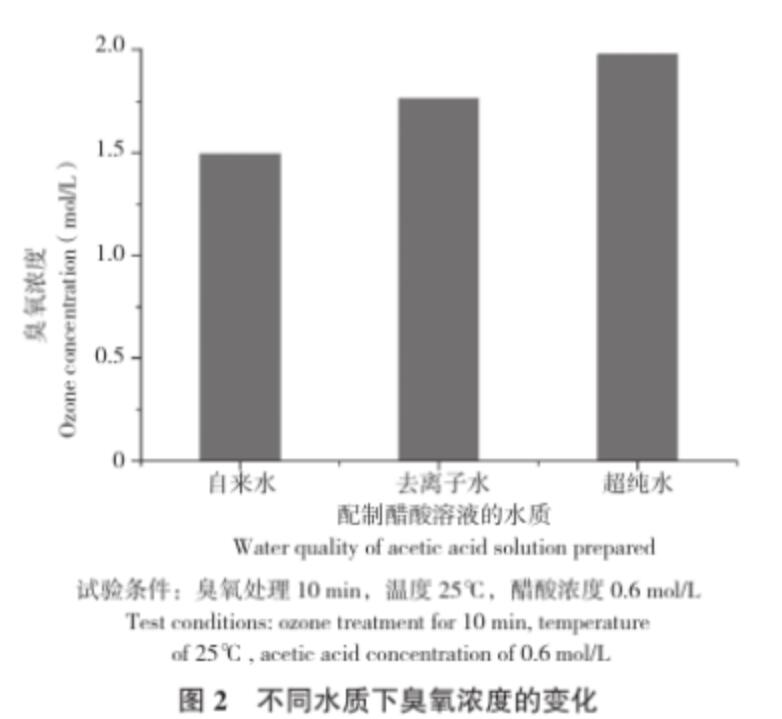
圖2 不同水質下臭氧濃度的變化
試驗條件:臭氧處理10 min,溫度25℃,醋酸濃度0.6 mol/L
Test conditions: ozone treatment for 10 min, temperature of 25℃, acetic acid concentration of 0.6 mol/L
2.4 放置時間對臭氧穩定性的影響
從圖3可以看出,在相同的試驗條件下,隨著放置時間的增加,醋酸溶液中的臭氧濃度急劇下降,當放置時間延長時,溶解的臭氧會有一部分揮發到空氣中,還有部分分解成氧氣,導致溶解度下降;在相同時間下,醋酸溶液中的臭氧濃度比去離子水中高,這表明臭氧在醋酸溶液溶液中比在水中更穩定,加入少量醋酸利于臭氧貯存。從圖4可以看出,臭氧處理后放置3 h的醋酸有較為尖銳的吸收峰,其譜峰3 468 cm-1、3 437 cm-1、3 467 cm-1歸屬于O-H引起的伸縮振動,譜峰 1 643 cm-1、1 638 cm-1、1 640 cm-1歸屬于C=C引起的伸縮振動,譜峰685 cm-1、676 cm-1歸屬于C-O引起的伸縮振動。而臭氧剛處理完的醋酸以及未處理的醋酸的峰值不同,說明生成的O-H鍵和C-O導致吸收峰移動,從而造成它們的峰值有所偏移。
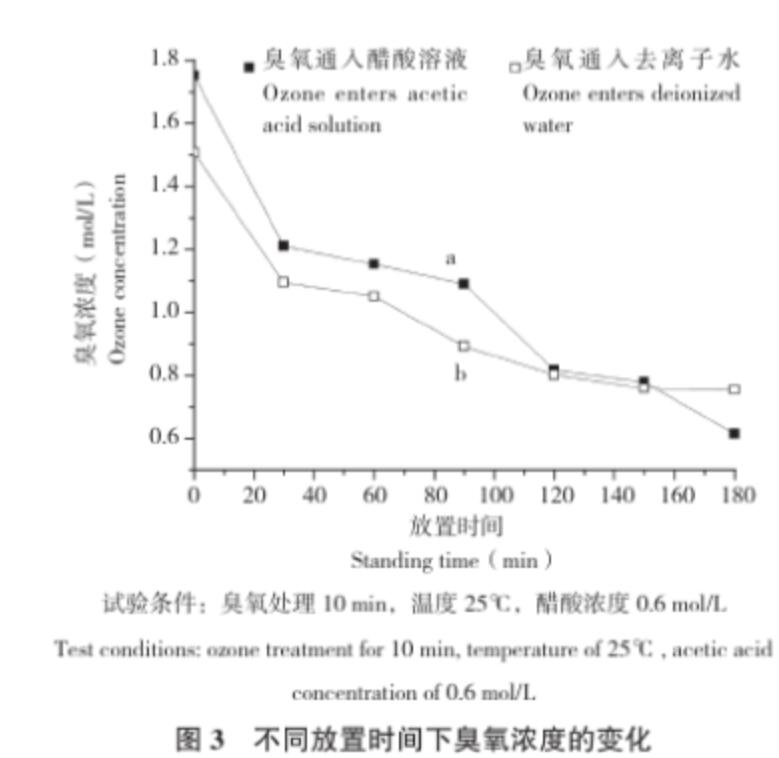
圖3 不同放置時間下臭氧濃度的變化
試驗條件:臭氧處理10 min,溫度25℃,醋酸濃度0.6 mol/L
Test conditions: ozone treatment for 10 min, temperature of 25℃, acetic acid concentration of 0.6 mol/L
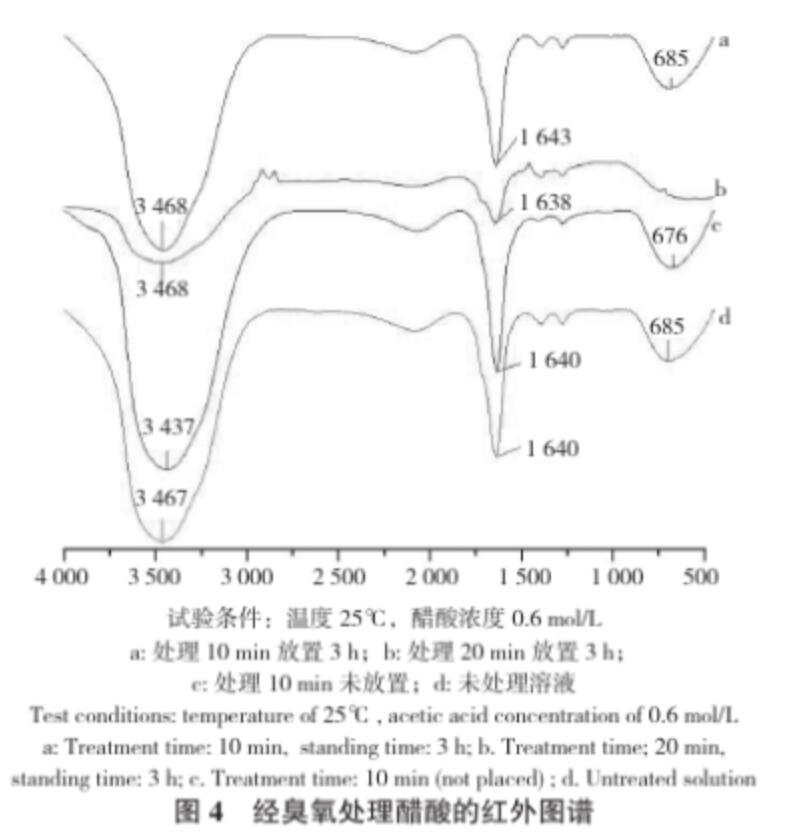
圖4 經臭氧處理醋酸的紅外圖譜
試驗條件:溫度25℃,醋酸濃度0.6 mol/L a: 處理10 min 放置3 h;b:處理20 min放置3 h;c:處理10 min未放置;d:未處理溶液
Test conditions: temperature of 25℃, acetic acid concentration of 0.6 mol/L a: Treatment time: 10 min, standing time: 3 h; b. Treatment time; 20 min,standing time: 3 h; c. Treatment time: 10 min (not placed) ; d. Untreated solution
2.5 溫度對臭氧穩定性的影響
圖5顯示,隨著溫度上升,醋酸溶液中的臭氧濃度迅速減少。張暉等[20]在研究水中臭氧分解動力學時,發現溫度的升高必然加速臭氧的自分解,臭氧在水中的分解實質上是通過一系列的中間過程, 很后生成氧氣的化學反應,水溫升高,該化學反應就加快。方敏等[9]也同樣證實了水溫越低,臭氧分解越慢,反之,水溫升高,臭氧分解加快。這些報道與本試驗結果一致,因此適當降低溫度,有利于獲得高濃度的臭氧溶液。
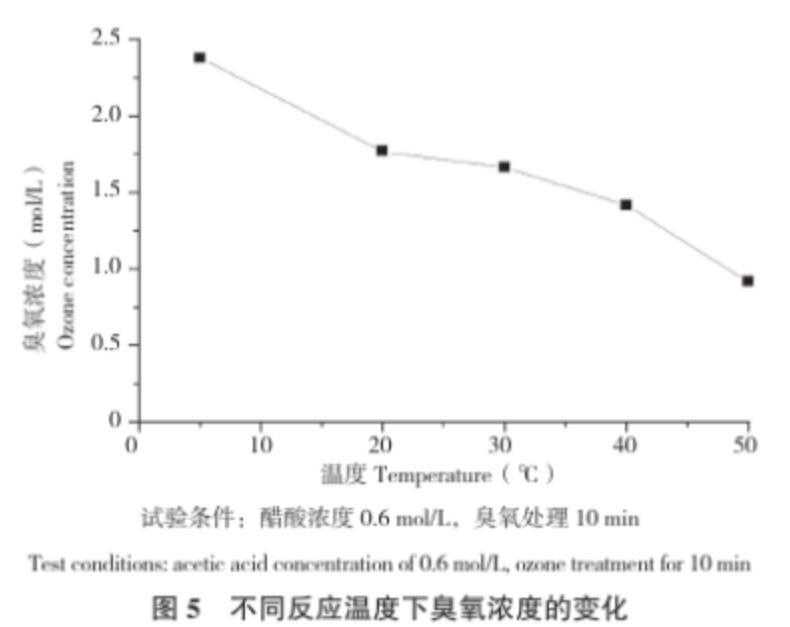
圖5 不同反應溫度下臭氧濃度的變化
試驗條件:醋酸濃度0.6 mol/L,臭氧處理10 min
Test conditions: acetic acid concentration of 0.6 mol/L, ozone treatment for 10 min
2.6 通入臭氧氣體時間對臭氧穩定性的影響
從臭氧處理后未放置立刻測定的結果(圖6)可以看出,在相同的試驗條件下,隨著通入臭氧時間延長,醋酸溶液中的臭氧濃度增加,但是當通氣時間達到一定程度時,溶液中的臭氧濃度就慢慢地飽和,漸漸趨于平衡。通氣時間長,臭氧慢慢溶解在水中,水中溶解臭氧容量不斷增大,因此水中臭氧濃度也逐漸增大;當臭氧的溶解度達到平衡,則不再繼續溶解于水中,呈現平穩的狀態。醋酸溶液經臭氧處理20 min且放置3 h之后,取樣測定,結果溶液中醋酸濃度仍為0.6 mol/L。且該樣品的紅外圖譜(圖4)與未處理的醋酸溶液無明顯差異,這說明本試驗條件下,醋酸沒有分解,結構無明顯變化。
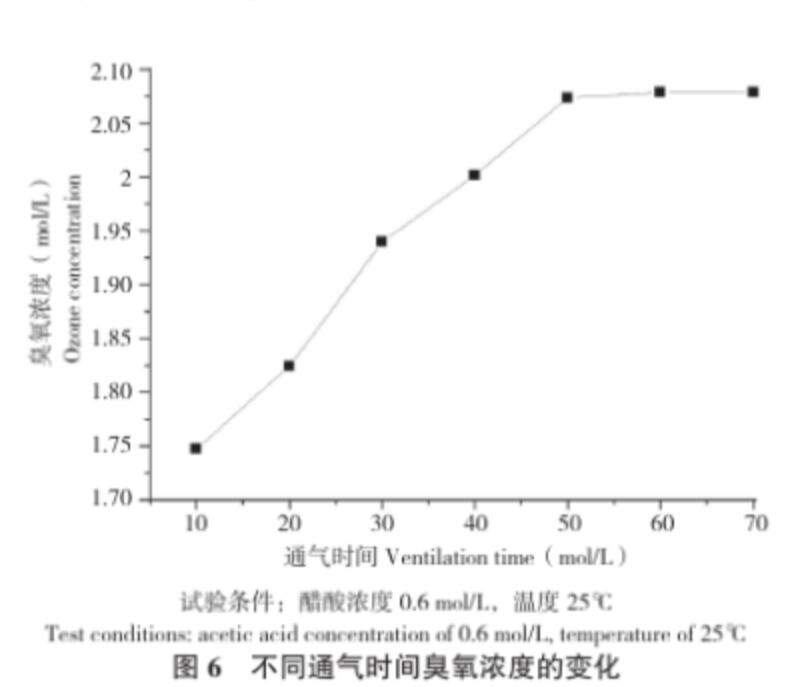
圖6 不同通氣時間臭氧濃度的變化
試驗條件:醋酸濃度0.6 mol/L,溫度25℃
Test conditions: acetic acid concentration of 0.6 mol/L, temperature of 25℃
3 討論
方敏等[9]與單于[10]、王華然等[5]對臭氧穩定性的試驗結論不同。方敏等[9]做了pH對臭氧分解速率的影響,根據他們的試驗結果進行分析,可以看出當溶液pH在3~4時,臭氧分解速率 很低。他們的試驗同時顯示,在水中加入少量的醋酸或檸檬酸可以提高臭氧的穩定性,當醋酸濃度為100 mg/kg時,臭氧的半衰期為299 min。經筆者理論計算,此時溶液的pH值為4.38。本論文的試驗顯示,醋酸濃度0.6 mol/L對提高臭氧濃度 很佳,過高、過低均不好,經理論計算,此時醋酸溶液的pH值為2.49。可見,本試驗結果與方敏等的試驗結論類似。綜合方敏等[9]及本試驗結果可以看出,不同pH值對臭氧在水中的穩定性影響很大, 很佳的pH值在2.5-4.4范圍的可能性 很大,這有待于進一步試驗。
孫廣明等[19]試驗顯示水純度高對臭氧在水中的穩定性有利,而本文的試驗卻顯示水中加入醋酸,這盡管降低了水的純度,但卻可以大大提高臭氧穩定性,但是,用于配制醋酸溶液的水純度越高,越利于臭氧在溶液中穩定存在。由于試驗條件限制,本試驗選擇了超純水、去離子水與自來水進行比較,結果顯示水純度高好,但該結論僅限于水中已有的污染物,這種代表性并不強,完全可能存在某種物質(尤其是其他有機酸),加入水中之后,更能提高臭氧的穩定性,這方面的工作也有待進一步開展。
本試驗表明,水中加入不超過0.6 mol/L醋酸,可以大大提高臭氧的穩定性,且溫度低一點好。這對于食品、醫藥等需要用臭氧進行雜菌消毒的領域有很好的指導作用。在實際需要用到臭氧水時,只要環境許可,在溶液中加入少量醋酸,預期可以提高臭氧的雜菌消毒效果或者延長其作用時間。
4 結論
通過醋酸濃度、臭氧處理時間、溫度、放置時間、水質等因素對臭氧溶解度的影響試驗,得出以下結論:醋酸濃度、通氣時間、溫度、放置時間、水質這5個因素都對臭氧在醋酸溶液中的溶解度具有顯著影響。試驗表明,當醋酸濃度為0.6 mol/L、溫度低于5℃、臭氧處理60 min左右時,臭氧的溶解度 很好,可以達到2.37 mg/L;且水質越純時,臭氧溶解度越大。因此選用高純水配制濃度為0.6 mol/L的醋酸溶液,在低溫環境下通入臭氧,對獲得高濃度臭氧水溶液更有利。
[1] HILL D G, RICE R G. Handbook of ozone technology and applications[J]. Ann Arbor Science, 1982(1):1- 37.
[2] 劉華慶.淺議臭氧氧化脫硝原理及對臭氧污染的影響[J].資源節 約 與 環 保,2017(10):74-75,78. doi:10.16317/j.cnki.12-1377/x.2017.10.041.LIU H Q. Brief discussion on the principle of ozone oxidation denitrification and its impact on ozone pollution[J]. Resource saving and environmental protection, 2017(10): 74-75,78. doi:10.16317/j.cnki.12-1377/x.2017.10.041.
[3] TOMIYAS H H, FUKUTOMI G G. Kinetics and mechanism of ozone decomposition in basic aqueous solution[J]. Inorg Chem, 1985, 24:2962-2966.
[4] TAUBE H, Bray W C. Chain reactions in aqueous solutions containing ozone, hydrogen peroxide and acid[J]. J Am. Chem, 1940(2):3357-3373.
[5] 王華然,王尚,李昀橋,王福玉,李迎凱,尹靜. 臭氧在水中的溶解特性及其影響因素研究[J].中國消毒學雜志,2009,26(5):481-483.WANG H R, WANG S, LI Y Q, WANG F Y, LI Y K, YIN J. Study on the dissolution characteristics of ozone in water and its influencing factors[J]. Chinese Journal of Disinfection, 2009, 26(5): 481-483.
[6] 許偉堅. 臭氧緩釋水溶膠的制備及條件研究[D].北京:北京化工大學,2017.XU W J. Study on preparation and conditions of ozone sustained-release hydrosol[D]. Beijing: Beijing University of Chemical Technology, 2017.
[7] WALTER R H, SHERMAN R M. Duration of ozone in water in the upper solubility range[J]. Journal of food science, 1976,41:993-995.
[8] SEHESTED K. Ozone decomposition in aqueous acetate solutions[J].Phys Chem, 1987,91:23-59.
[9] 方敏,沈月新,方競,王鴻.臭氧水穩定性的研究[J].食品科學,2002(9):39-43.FANG M, SHEN Y X, FANG J, WANG H. Study on the stability of ozone water[J]. Food Science, 2002 (9): 39-43.
[10] 單于.提高臭氧穩定性的方法[J].化學世界,1965(4):157-158.doi:10.19500/j.cnki.0367-6358.1965.04.006.SHAN Y. Methods to improve ozone stability[J]. Chemical World,1965 (4): 157-158. doi:10.19500/j.cnki.0367-6358.1965.04.006.
[11] 趙利會. 臭氧—生物活性碳凈水工藝運行條件優化研究[D]. 重慶:重慶交通大學,2011.ZHAO L H. Operating conditions optimization of ozone-biologically activated carbon water purification process[D]. Chongqing: Chongqing Jiaotong University, 2011.
[12] 楊棟梁.一種大幅提高臭氧在水中的溶解度和穩定性的方法[P].中國 :CN101380552,2009-03-11.YANG D L. A method to improve the solubility and stability of ozone in water[P]. China Patent: CN101380552, 2009-03-11.
[13] 劉偉成,任艷群,許桂順.幾種常見有機溶劑的主要性質[J].化工設計通訊,2016,42(7):12-13.LIU W C, REN Y Q, XU G S. Main properties of several common organic solvents[J]. Chemical Design Communication, 2016, 42 (7):12-13.
[14] 李熙,徐琴堂,蔣富明,劉效疆.甲酸、乙酸或水單一溶劑的偶極矩與鹽濃度的關系[J].高等學校化學學報,1992(9):1260-1262.LI X, XU Q T, JIANG F M, LIU X J. The relationship between dipole moments of formic acid, acetic acid or water solvents and salt concentration[J]. Journal of Chemistry of Colleges and Universities,1992 (9): 1260-1262.
[15] 戴金福,趙東漢.臭氧是極性分子嗎?[J].化學教學,1987(3):27-28.DAI J F, ZHAO D H. Is ozone a polar molecule?[J]. Chemistry Teaching, 1987 (3): 27-28.
[16] 代欣欣,李汴生.水中臭氧溶解特性的研究[J].食品科技,2008(8):84-87.doi:10.13684/j.cnki.spkj.2008.08.065.DAI X X, LI B S. Study on ozone dissolution in water[J]. Food Science and Technology, 2008(8): 84-87. doi:10.13684/j.cnki.spkj.2008.08.065.
[17] 譚桂霞,陳燁璞,徐曉萍.臭氧在氣態和水溶液中的分解規律[J].上海大學學報(自然科學版),2005(5):510-512.TANG X, CHEN Y P, XU X P. Decomposition of ozone in gaseous and aqueous solutions[J]. Journal of Shanghai University (Natural Science Edition), 2005 (5): 510-512.
[18] 許榮年,鮑忠定.臭氧對水質的影響[J].食品工業科技,1999(1):61-62. doi:10.13386/j.issn1002-0306.1999.01.030.XU R N, BAO Z D. Effects of ozone on water quality[J]. Food Industry Science and Technology, 1999(1):61-62. doi:10.13386/j.issn1002-0306.1999.01.030.
[19] 孫廣明,李寶華,李漢忠.臭氧特性及對水質的凈化作用[J].漁業現代化,2000(4):23-26,31.SUN G M, LI B H, LI H Z. Ozone characteristics and water purification[J]. Fisheries Modernization, 2000(4): 23-26,31.
[20] 張暉,楊卓如,陳煥欽.水中臭氧分解動力學研究[J].環境科學研究,1999(1):20-22. doi:10.13198/j.res.1999.01.20.zhangh.005.ZHANG H, YANG Z R, CHEN H Q. Kinetics of ozone decomposition in water[J]. Environmental Science Research, 1999 (1): 20-22.doi:10.13198/j.res.1999.01.20.zhangh.005.
Study on Dissolution and Stability of Ozone in Acetic Acid Solution
標簽:臭氧(80)溶解(5)研究(2)醋酸溶液(1)穩定性(1)













