
氧化電勢,或稱氧化還原電勢,是對化學物種獲取電子并被還原的趨勢的度量。氧化電位以電壓測量。較大的氧化電位表明有更大的趨勢被還原,從而與其他化學物種產生電子交換。
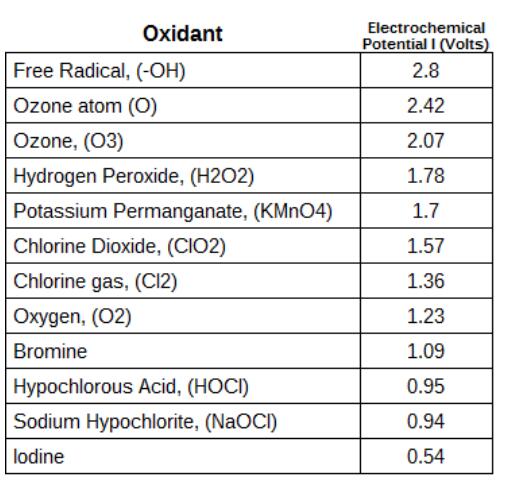
臭氧具有 很高的氧化電勢之一,僅低于花青素原子,氧原子和羥基自由基。臭氧的某些反應會產生氧原子和羥基自由基,從而產生比單獨的臭氧更高的氧化電位。
由于具有高氧化能力,因此氧分子具有與許多不易被其他化學物質氧化的化合物反應的能力。與某些無機物(例如FE + 2和I-)的反應特別重要。但是,在許多情況下,沒有明確的電子轉移,而是從臭氧分子到其他化合物的氧轉移。
臭氧和鐵離子交換氧化的例子:
Fe + 2 + O3 = FE + 3 + O3-
臭氧和鐵的氧原子交換氧化的示例:
2Fe2 + + O3 + H2 O→2Fe3 + + O2 + 2OH-
有機和無機化合物均可發生兩種反應。這只是臭氧氧化反應的一個簡單例子。
標簽:臭氧(80)氧化電位(1)
相關文章:













