
一、 實驗目的
臭氧可以氧化廢水中的不飽和有機物,而且還能使芳香烴化合物開環和部分氧化,使一些大分子的有機物降解為小分子,提高廢水的可生化性。臭氧極不穩定,在常溫下分解為氧。
1.了解特性,掌握臭氧濃度測定方法;
2.通過對染色廢水的處理,了解臭氧處理工業廢水的基本過程。
二、 實驗儀器及設備
實驗儀器:臭氧發生器,洗氣瓶,堿式滴定管,量筒,錐形瓶,pH試紙,分光光度計,大燒杯;
實驗試劑:2%的KI溶液,醋酸,0.005mol/L的Na2S2O3 ,1%淀粉溶液,蒸餾水,分散藍溶液
三、實驗原理
臭氧是一種強氧化劑,它的氧化能力在天然元素中僅次于氟。臭氧在污水處理中可用于除臭、脫色、殺菌、消毒、降酚、降解COD、BOD等有機物。
臭氧在水溶液中的強烈氧化作用,不是臭氧本身引起的,而主要是由臭氧在水中分解的中間產物·OH基及HO2基引起的。很多有機物都容易與臭氧發生反應。例如臭氧對水溶性染料、蛋白質、氨基酸、有機氨及不飽和化合物、酚和芳香族衍生物以及雜環化合物、木質素、腐殖質等有機物有強烈的氧化降解作用;還有強烈的殺菌、消毒作用。
臭氧氧化的優點:
1.臭氧能氧化其它化學氧化,生物氧化不易處理的污染物,對除臭、脫色、殺菌、降解有機物和無機物都有顯著效果;
2.污水經處理后污水中剩余的臭氧易分解,不產生二次污染,且能增加水中的溶解氧;
3.制備臭氧利用空氣作原料,操作簡便。
工業上采用高壓(1.5—3萬伏)高頻放電制取臭氧,通常制得的是含1—4%臭氧的混合氣體,稱為臭氧化氣體。
1.臭氧氧化有機物的機理:
1)直接反應機理—臭氧分子直接進攻有機物的反應
(1)打開雙鍵,發生加成反應:借助其偶極結構同有機物的不飽和鍵發生加成反應,形成臭氧化中間產物,并進一步分解。
R1C=CR2+O3 分解為 R1GCOOH+R2C=O G代表-OH、-OCH3、-OCOCH3
(2)親電反應
(3)親核反應
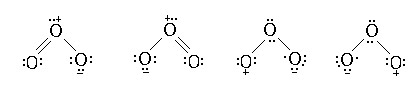
臭氧分子的共振三角形結構表明,它可以作為偶極試劑、親電試劑和親核試劑,與有機物形成三類反應。
2)間接反應機理—臭氧分解形成自由基與有機物的反應
溶解性臭氧分解形成羥基自由基,HO·通過不同的反應使溶解態無機物和有機物氧化。
鏈引發-傳遞-終止
(1)溶解性臭氧的分解機理
HSB (Hoigne, Staehelin和Bader) 機理
GTF (Gorkon, Tomiyasn和Futomi) 機理
(2)HO·與溶解態化合物間的反應
電子轉移反應——從其它物質上抽取電子, 自身還原為OH-;
抽氫反應 ——從有機物的不同取代基上抽取H使有機物變為有機物自由基, 自身則轉變為H2O;
OH·加成反應 — OH·加成到烯烴或芳香碳氫化合物雙鍵上.
臭氧脫色的機理是臭氧及其產生的活潑自由基OH·使染料發色基團中的不飽和鍵(芳香基或共軛雙鍵)斷裂生成小分子量的酸和醛,生成了低分子量的有機物,從而導致水體色度顯著降低。臭氧對親水性染料的脫色速度快,效果好;對疏水性染料的脫色速度慢,效果差,且需臭氧量大。臭氧可氧化鐵、錳等無機有色離子為難溶物臭氧的微絮凝效應還有助于有機膠體和顆粒物的混凝,并通過過濾去除致色物。
2.臭氧氧化性能的影響因素--溶液pH
pH的變化將改變臭氧氧化反應的作用機理和去除效果
1)臭氧本身的氧化能力與pH 值有關
臭氧在水中的分解速度隨著pH 值的提高而加快 ,在pH<4時,臭氧在水溶液中的分解可以忽略不計,其反應主要時溶解臭氧分子同被處理水溶液中還原性物質的直接反應;在pH>4時,臭氧的分解便不可忽略,在pH更高時,則臭氧主要是在OH的催化作用下,經一系列鏈式反應分解成具有高反應活性的自由基而對還原性物質進行非選擇性氧化降解。 如果pH值提高一個單位臭氧分解大約快3倍。
2)污水中有機物或無機物的物理化學性質與pH值有密切關系
3)臭氧吸收率與pH值有一定關系
pH 值在整個臭氧氧化過程中的變化,主要是在中性或堿性條件下pH值會隨著氧化過程而呈下降趨勢,其原因是有機物氧化成小分子有機酸或醛之類物質。堿性條件下的污染物去除率高于酸性條件
3.臭氧氧化性能的影響因素--溶液溫度
提高反應溶液溫度將使反應的活化能降低,有利于提高化學反應速率。但是,隨溫度的升高,臭氧其分解將加速,溶解度降低,從而降低了液相中臭氧的濃度,減緩化學反應速度。同時,由于臭氧氧化有機物的反應是一個連串反應,在降解有機物的同時也要對其氧化中間產物進行深度氧化,消耗液相中的臭氧,減緩目標有機物的降解速率。為與工業實際廢水相接近,實驗選擇溫度范圍為3~30度。
4.臭氧氧化性能的影響因素--催化劑
堿催化臭氧氧化:如O3/H2O2,它們是通過OH-來催化產生·OH而對有機物進行降解;光催化臭氧氧化:如O3/UV、O3/H2O2/UV,這里要注意UV是一定波長的;多相催化臭氧氧化:如O3/固體催化劑(如活性炭、金屬及其氧化物,中國煤科院和北京同林共同開發的二氧化錳復合氧化物,有很好的催化作用,效率可以提高1.5倍)。
5.臭氧技術在應用中存在的問題
低濃度臭氧處理有機物時不能將其完全氧化為二氧化碳和水,而是生成一系列中間產物,如醛、羧酸等;臭氧溶解度低,限制了臭氧在水處理中的應用。臭氧生產中對進入發生器的空氣質量要求高,且臭氧有腐蝕性,要求設備和管路使用耐腐蝕材料或作防腐處理;臭氧極不穩定 重量濃度為1%以下的臭氧在常溫(常壓)的空氣中的半衰期為16小時,水中臭氧濃度為3 mg/L時,半衰期僅30分鐘左右。
實驗原理思考:
1.廢水經臭氧反應后,CODcr是否會升高,為什么?
答:可能會升高。
1)臭氧的作用有分解大分子基團,把一些原本無法檢測的物質變成顯性的。所以如果在作用的初期即臭氧投加量較小的時候,或是臭氧在臭氧接觸池內傳質效率低,或是停留時間不足,都有可能影響到COD的降解效果,使得原來比較穩定難降解大分子物質(不顯COD)變成易降解的小分子物質(顯COD)。這樣就會出現CODcr升高的情況。這個現象在很多學校試驗中被證實。總有學生很惶恐的說:你的臭氧發生器給我的廢水投加了COD!
2)實驗設備引起,如:乳膠管插在水中就可被氧化使的CODcr升高。為了避免此類現象的發生,需采用耐氧化硅膠管或者不銹鋼管進行試驗。
2、有些廢水在使用臭氧處理的時候,會出現大量泡沫,怎么處理?
答:有些廢水會含有發泡劑類物質,此類試驗需要用三氯化鐵、硫酸鋁或者聚合氯化鋁等做下混凝預處理,再進行臭氧處理。
四、實驗步驟
1.臭氧濃度的測定:
用量筒取250ml 的2%的KI溶液加入氣體吸收瓶,然后通入臭氧 90s,取100ml反應液于錐形瓶中,用醋酸酸化至pH=4,用0.005mol/L的Na2S2O3滴至淡黃色,加入1%淀粉溶液,繼續滴定至無色,記錄滴定消耗Na2S2O3的體積。
2.臭氧脫色效率的測定:
(1)取兩個氣體吸收瓶,分別裝入250ml直接藍溶液和2%的KI溶液,用膠管連接通臭氧 45s。
(2)取分散藍溶液反應液在 很大吸收波長580nm下測吸光度,計算臭氧的溢出量,求臭氧的脫色效率和吸收率。
(3) 取反應后KI溶液100ml于錐形瓶中,用醋酸酸化至pH=4,用0.005mol/L的Na2S2O3滴至淡黃色,加入1%淀粉溶液,繼續滴定至無色,記錄滴定消耗Na2S2O3的體積。
(4)調解原水的pH為3和10,重復(1)(2)(3)。
測定臭氧在水中的濃度,采用碘量法
臭氧先用KI溶液吸收,生成I2用Na2S2O3標準溶液滴定
O3+2KI+H2O===O2+I2+2KOH
I2+2Na2S2O3===Na2S4O6+2NaI
測定方法:
1、臭氧吸收:取250mL 2%KI溶液于吸收瓶中,通入臭氧化氣1.5min。
2、取吸收臭氧的KI溶液(2%)溶液100ml于錐形瓶中,用冰醋酸酸化調pH=4用0.005mol/LNa2S2O3標準溶液滴定至淡黃色時,再加入1%淀粉指示劑,此時溶液為藍色,再迅速滴定至藍色消失為終點。
注意:對于不同pH值得有色溶液,要注意溶液臭氧吸收量與脫色率之間的聯系。
標簽:
相關文章:










